En mars dernier, le laboratoire Généthon a commencé les essais cliniques pour la myopathie de Duchenne, une maladie génétique rare. Frédéric Revah, son directeur, revient sur le travail de Généthon.
Le 17 mars dernier, un premier enfant a reçu un traitement contre la myopathie de Duchenne, une maladie génétique rare qui touche 2.500 personnes en France. Le laboratoire Généthon est à l’origine du développement de ce traitement, issu de la thérapie génique. Dans cette interview, Frédéric Révah, directeur de Généthon, revient sur les avancées de la thérapie génique, les apports de Généthon dans le domaine et ses enjeux en France, et la coopération internationale dans le domaine de la recherche.
Quel est l’objectif de Généthon ?
Généthon est le laboratoire créé par l’AFM-Téléthon en 1990. Il a comme obejctif de développer des traitements pour les maladies génétiques rares, L’essentiel de ces maladies, qui concernent près de 7.000 maladies, 3 millions de patients en France et 30 millions en Europe, son un vrai problème de santé publique.
Quand Généthon a été créé, la première phase a consisté à participer au déchiffrage du génome humain, inconnu en 1990. L’ADN qui est dans nos cellules, est une molécule chimique constituée de 3 milliards d’unités élémentaires, que l’on appelle des bases, qui sont comme des lettres. Le génome humain est comme un livre qui ferait 3 milliards de lettres. Il suffit d’une seule erreur pour provoquer une maladie génétique. Cet ADN est comme le disque dur de chaque cellule, et chacune va chercher dans l’ADN les instructions pour son fonctionnement. Dans cet ADN, il y a des gènes, qui sont des blocs fonctionnels agissant comme des programmes. Personne n’a le même ADN, à part les vrais jumeaux. Les variations d’ADN sont naturelles, ce qui fait nos différences. Si ces mutations touchent une zone du gène ou du programme essentiel au fonctionnement de la cellule, cela provoque une maladie génétique.
La thérapie génique consiste à apporter dans les cellules malades une copie normale du gène muté, un morceau d’ADN, de manière à compenser les effets de la mutation et à retrouver un fonctionnement normal.
En quoi consistent la thérapie génique et le travail réalisé par Généthon aujourd’hui ?
Les maladies rares ont toutes pour origine une mutation génétique. Trouver une erreur dans 3 milliards de lettres est très complexe. Dans les années 1980, identifier le gène responsable d’une mutation génétique pouvait prendre des années. En établissant les premières cartes du génome humain entre 1992 et 1996, - qui seront achevées par d’autres équipes au début des années 2000, nous avons en quelque sorte restitué la table des matières. Cela nous permet d’aller beaucoup plus vite, d’identifier des gènes en quelques semaines. Ces outils ont été un formidable accélérateur de la recherche en génétique.
Nous sommes ensuite concentré nos efforts sur la thérapie génique, qui consiste à apporter dans les cellules malades une copie normale du gène muté, un morceau d’ADN, de manière à compenser les effets de la mutation et à retrouver un fonctionnement normal. Ce morceau d’ADN est une grosse molécule chimique, qui ne rentre pas spontanément dans les cellules. Il est impossible de fabriquer de l’ADN et de le donner sous forme de cachets. Nous utilisons des transporteurs, qui sont des composantes de virus reconstituées en laboratoires car, dans la nature, les virus pénètrent dans les cellules. Nous n’utilisons pas des virus entiers, nous reconstituons la partie qui permet d’entrer dans la cellule mais libérée de la partie pathogène. Le produit de thérapie génique est un gène thérapeutique, couplé à des composantes de virus, qui permettent à ce gène de pénétrer dans les cellules.

La myopathie de Duchenne est une maladie dégénérative des muscles qui touchent exclusivement des garçons, car le gène muté est sur le chromosome X.
Fin 2020, vous avez obtenu l’autorisation d’un essai clinique sur la myopathie de Duchenne, et le premier enfant a été injecté le 17 mars. Comment fonctionne ce traitement ?
La myopathie de Duchenne est une maladie dégénérative des muscles qui touchent exclusivement des garçons, car le gène muté est sur le chromosome X. Les mutations sont dans un gène qui est responsable de la fabrication d’une protéine, la dystrophine. C’est une composante musculaire, une protéine du muscle, qui le protège lors des contractions. Quand ce gène est muté, le muscle dégénère progressivement, au fur et à mesure que l’enfant grandit. Ce sont des enfants « normaux » mais qui, au bout de quelques années, auront du mal à courir, à monter des escaliers… Ils perdent progressivement l'usage de leurs membres inférieurs, les jambes, puis de leurs bras, de leur diaphragme - qui permet de respirer, et enfin, du cœur. Ces enfants meurent à l’adolescence ou au début de l’âge adulte. Maintenant, grâce à une prise en charge adaptée, les malades peuvent atteindre une trentaine d’années, mais dans des conditions extrêmement difficiles.
L’objectif est d’apporter une copie normale du gène de la dystrophine. Mais il s’agit du plus grand gène du génome humain. Il est trop grand pour rentrer dans les transporteurs. La première étape a été de concevoir une forme réduite de ce gène, la microdystrophine, plus petite mais qui conserve ses propriétés clés. Nous avons fait cela en coopération avec une équipe anglaise du University College de Londres. Le premier patient a été traité courant mars, l’objectif étant de préserver la force musculaire. Le patient en question est un garçon de moins de dix ans qui a encore l’usage de la marche. Nous essayons de traiter le plus tôt possible, pour être plus efficaces. C’est le premier enfant d’un essai clinique qui devrait continuer pendant quatre à cinq ans. Nous devrions traiter des enfants en France, mais également en Angleterre, aux Etats-Unis et en Israël.
Il est très important pour nous de trouver des partenaires industriels pour accélérer le développement, en apportant des financements et des expertises complémentaires.
Comment s’organise la coopération pour la recherche à l’international et quels sont ses enjeux ?
En tant que promoteurs de l’essai clinique, nous en avons la responsabilité. Nous déposons des dossiers de demande d’autorisation des essais cliniques auprès des autorités de chaque pays. Nous avons reçu l’autorisation de l’Agence nationale de sécurité du médicament et de produits de santé (ANSM) en décembre, puis de l’agence britannique du médicament. Nous espérons avoir dans les mois qui viennent celles des agences américaine et israélienne. Nous travaillons également en co-développement avec une société de Biotech américaine, Sarepta Therapeutics, qui co-finance le développement du médicament. Il est très important pour nous de trouver des partenaires industriels pour accélérer le développement, en apportant des financements et des expertises complémentaires.
Quels autres médicaments développez-vous ?
Aujourd’hui, dix produits issus de Généthon sont en cours d’essais cliniques. Il y a aujourd’hui, sur le marché, un traitement contre l’amyotrophie infantile qui s’appuie sur les technologies développées à Généthon. Plus de 1.000 patients ont été traités à travers le monde.L’amyotrophie spinale est une maladie gravissime, puisque les enfants en meurent avant l’âge de 2 ans. Nous espérons l'arrivée sur le marché de deux autres produits cette année, l’un pour une maladie rare de la vision pour lequel nous avons contribué et l’autre pour la myopathie myotubulaire, une maladie très sévère des muscles, conçu à Généthon.
Nous pensons que l’intelligence artificielle peut nous servir à concevoir des vecteurs plus efficaces et spécifiques.
Vous avez récemment signé un partenariat avec WhiteLab Genomics, un spécialiste français de l’utilisation de l’intelligence artificielle dans la recherche sur les thérapies géniques et cellulaires. Quel rôle l’IA peut-elle jouer dans l’élaboration de traitements ?
Nous pensons que l’IA peut nous servir à concevoir des vecteurs plus efficaces et spécifiques. Aujourd’hui, nous utilisons comme vecteurs des composantes de virus naturelles, en particulier des virus adéno-associés, pour lesquels il existe différentes classes et sérotypes. Nous introduisons parfois des variations ou des améliorations ponctuelles, car certains virus sont plus efficaces dans le muscle, le foie, ou encore la rétine. L’IA nous permet d’exploiter au mieux toute l’information sur ces différents vecteurs, afin de concevoir et proposer de nouvelles stratégies et de nouveaux vecteurs.
Avec la crise sanitaire, tout le monde est aujourd’hui bien conscient de l’importance de disposer de capacités de production sur le territoire français.
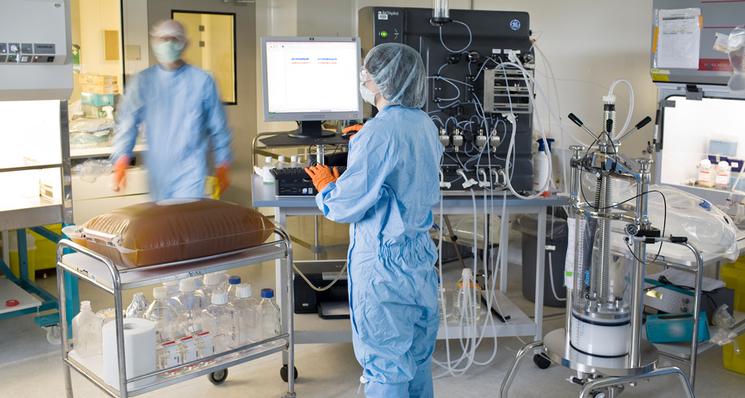
Depuis 2016, la plateforme pharmaceutique industrielle YposKesi fabrique des médicaments issus de thérapies innovantes. Quels sont les enjeux de la production industrielle de ces médicaments en France ?
Les médicaments de thérapie génique sont extrêmement compliqués à produire, bien plus que des molécules chimiques comme l’aspirine ou le paracétamol. Produire ces médicaments de thérapie génique ne se fait pas par les voies de la chimie, mais par la biotechnologie, comme les vaccins, ou encore les anticorps monoclonaux. Pour prendre l’exemple des vaccins, ceux-ci produisent des virus inactivés. Une dose de vaccin correspond à environ un million de particules virales. Pour une dose pour un patient atteint de myopathie de Duchenne, il faut compter un milliard de fois plus. Nous ne pouvons pas utiliser les mêmes méthodes que pour les vaccins. Il y a donc des technologies spécifiques, une innovation technologique nécessaire..
Si nous n’avions pas créé notre propre plateforme de production industrielle de médicaments de thérapie génique, nous ne pourrions pas faire ces essais cliniques. Lors de sa création, c’était la plus importante au monde. Sans cette plateforme, il faudrait s’adresser à d’autres acteurs, avec le risque de ne pas être prioritaires ou de ne pas disposer des capacités de production. L’enjeu crucial autour de la thérapie génique est d’avoir les moyens de produire en France. Depuis un mois, un nouveau partenaire est entré au capital, un grand groupe industriel coréen. Ils ont des compétences synergiques et apportent des financements importants, qui vont permettre à YposKesi de continuer à se développer, de doubler ses capacités de production, et de disposer en France d’un leader dans la bioproduction de thérapie génique.
Avec la crise sanitaire, tout le monde est aujourd’hui bien conscient de l’importance de disposer de capacités de production sur le territoire français.
Cette interview a été réalisée par Caroline Chambon.
Sur le même sujet